كل ما يلزم معرفته عن الهندسة الوراثية
يعد استخدام التكنولوجيا الحيوية وتطبيقاتها المختلفة ثورة علمية وحضارية بدأتها الدول المتقدمة وأحرزت انتصارات علمية كبيرة وانجازات مشهودة ، مما دعى دول أخرى الى أن تحذو حذو تلك الدول المتقدمة وتستفيد من تطبيقات التكنولوجيا الحيوية فى تنمية المجتمع والنهوض به.
وتعتبر الهندسة الوراثية وتطبيقات التكنولوجيا الحيوية علامة مميزة على مدى تقدم الشعوب نظرا لما تتطلبه من إمكانيات علمية عالية وأبحاث متطورة وتجارب معملية وحقلية تأخذ سنوات عديدة وتخضع لتقييم دقيق من عدة جهات مختصة، كما تخضع لقواعد وارشادات وقوانين تهدف إلى سلامة الانسان والحيوان والبيئة .
تعريف:
الهندسة الوراثية هي التقنية التي تتعامل مع الجينات أو الوحدات الوراثية المتواجدة على الكروموزومات فصلاً ووصلاً وإدخالاً لأجزاء منها من كائن إلى آخر بغرض إحداث حالة تمكن العلماء من معرفة وظيفة (الجين) أو بهدف الحصول على طبعات كثيرة من نواتجه أو بهدف استكمال ما نقص منه في خلية مستهدفة.
ولشرح ذلك نقول، بعد أن عرف العلماء طبيعة ووظيفة الصبغيات أو الكروموزومات وهي أجسام صغيرة جداً لا ترى بالعين وتوجد داخل كل خلية، وهي مكونة من أشرطة مسجل عليها صفات الكائن المادية، وهذه الأشرطة تسمى الجينات.
وتقدم العلم فاكتشف أن هذه المورثات أو حاملات الصفات ما هي إلا سلم مزدوج من مادة تسمى D.N.A الحمض النووي المعروف الآن بحامل الشفرة الوراثية وبعدها درس العلماء خصائصه وتعرفوا عليها ، فماذا وجدوا ؟ لقد وجدوا ما يأتي…
1. أن D.N.Aهو حامل الشفرة الوراثية .
2. أن الصفات التي يحملها تترجم منه إلى بروتينات تتجسد على هيئة الصفة المطلوب تنفيذها.
3. أن كل خيط يمكن أن يكون قالباً يتكون عليه خيط جديد يتزاوج معه مستخدماً وحداته البنائية من السيتوبلازم .
4. أنه يمكن قطع ووصل هذا اللولب المزدوج بوسائل تقنية متعددة وفي أماكن مختلفة . كما يمكن بسهولة فصل زوجي اللولب.
5. أنه يمكن قص ولصق قطعة منه من مكان لآخر.
6. أن تغييراً أو تدميراً يشوه هذا النظام يؤدي إلى: إما نتيجة قاتلة للكائن أو حالة مرضية مترتبة على تعطل صفة من صفاته والتي تختلف من حيث أهميته
7. إن تركيب D.N.A ومكوناته هي [ سكر ، وأدنين ، وفوسفات ] وهذه التركيبة مشتركة في جميع الكائنات من الفيروس إلى الفيل .
8. وهذه الملحوظات فتحت الطريق أمام العلماء لمزيد من التجارب من خلال إدخال وإخراج أجزاء من هذه الشفرة الوراثية ومن خلال قطع ووصل أجزائها بل ومحاولة إدخال أجزاء من D.N.A لكائن معين إلى أجزاء من D.N.A لكائن آخر .
ومن خلال ذلك انفتحت الأبواب أمام علوم ما يسمى بالهندسة الوراثية، فقد تمكن العلماء من إدخال جينات (مورثات) من حيوان إلى بكتريا، بل ومن إنسان إلى بكتريا أو حيوان، وكانت المفاجأة المذهلة أن البكتريا المطعمة بالجين الغريب أخذت في الانقسام لتنتج طبعات كثيرة من هذا الجين أُمكن من خلالها دراسته دراسة مستفيضة، بل وأُمكن من خلال إدخال جينات – قطع حاملة لبعض الصفات – معينة من الإنسان إلى الحيوان أن نحصل على نواتج ذلك (الجين) بكميات كبيرة من خلال ألبان هذا الحيوان.
وأُمكن من خلال هذه الهندسة الحصول على الأنسولين البشري وعامل التجلط البشري بل وعوامل إذابة الجلطة، وعامل النمو البشري بكميات كبيرة ما كان للإنسان أن يصل إليها أبداً من مصادرها.
وسنضرب لذلك الأمثلة التالية:
جاء في مجلة العلوم الأمريكية مجلد 13 عدد 4 أبريل 1997 (ترجمة الكويت) جاء ما يأتي:
في عام 1981 أوضح ( W.J كوردن )وزملاؤه في جامعة يال : أن الجنين المخصب لفأريستطيع أن يدمج مادة جينية غريبة (D.N.A) في صبغياته (مورثاته) وبعدها جاء علماء من جامعة (أوهايو) الذين برهنوا أن الجين (وهو قطعة من D.N.Aتحمل رموزاً لبروتين معين المأخوذ من الأرنب يمكن أن يؤدي وظيفته في الفأر بعد حقنه في جنين فأر وحيد الخلية ) وكان من المدهش أن لاحظ العلماء أن D.N.Aالغريب والمحقون من خلايا الأرنب إلى خلايا الفأر سرعان ما يتكامل مع صفات الفأر ، ويحتمل أن تكون الخلية ميزته على أنه قطعة مكسورة من D.N.Aالخاص بها والذي يحتاج إلى ترميم .
وفي 1987 ظهر اكتشاف هام آخر يتعلق بالحيوانات المحورة جينياً، فقد قام مجموعة من العلماء بابتكار وسائل لتنشيط الجينات الغريبة في الغدة الثديية للفأر كان من نتيجتها تكوين جزيئات بروتينية غريبة وإفرازها في حليب الفأر المحور جينياً.
وتمخضت هذه الأبحاث الفذة على إمكان إنتاج البروتين البشري (منشط البلازمينوجين ) من خلال إدخال الجين البشري حامل هذه الصفة في الخلايا المنتجة للبن في حيوان مختار، لتكون النتيجة أن يخرج هذا البروتين بكميات كبيرة في لبن الحيوان لاستخدامه كوسيلة للعلاج في حالة نقص هذا البروتين في المرضى من البشر.
وقد طبقت هذه التقنيات في إنتاج بروتينات علاجية هامة مثل البروتينات المانعة للنزيف والمانعة للتجلط، ومن قبل أُمكن تخليق الأنسولين البشري من خلال إدخال جين بشري حاملاً لصفته داخل بكتريا معينة.
وواكب هذه الاكتشافات المبهرة حملة إعلامية عارمة لعب فيها الخيال العلمي دوراً مؤثراً على عقول عامة المثقفين وضعت علامات استفهام أمام الفكر الديني المستنير، فقد تناقلت أجهزة الإعلام أخبار عن إمكان أن يتقدم الآباء أو الأمهات بطلبات إلى العلماء للحصول على أطفال لها موصفات معينة في الشكل واللون والذكاء والقدرة الجسمانية أو العقلية، بل وذهب الخيال العلمي إلى إمكان إدخال جين (صفة) التمثيل الضوئي من النبات الأخضر إلى الأجنة البشرية للحصول على الإنسان الأخضر الذي يمكن أن يستخدم أشعة الشمس وثاني أكسيد الكربون من الجو للحصول على غذائه وطاقته، وبذلك لا يصبح هناك أي مشاكل اقتصادية لها علاقة بالغذاء.
وإذا كان ذلك كذلك فإن أسئلة هامة لا بد وأن تثار كالآتي:
1. هل يعتبر ذلك تدخلاً في شأن من شئون الله ؟ .
2. هل يعتبر ذلك تعديلاً لخلق الله إلى الأفضل ؟ .
3. هل يعتبر ذلك دليلاً على صدق النظرية المادية البحتة ؟ هل وهل وهل.
قبل أن نرد على هذه الأسئلة لا بد وأن نبين للعقل المفكر أن هذه الأسئلة زائفة أصلاً وباطلة عقلاً لأنها لا تعتمد على حقائق بل تعتمد على خيال وأوهام وضلالات كيف ؟
سأستعير الإجابة من كلام علماء الهندسة الوراثية والذين يعملون في هذا المجال كما يأتي:
يقول (إيرفين شار جاف) أحد مؤسسي علم البيولوجيا الجزيئية: إن اللعب في الجينات يعرضنا للخطر.
ويقول ( وليام بيتز ) عالم الهندسة الوراثية وصاحب مؤلف الهندسة الوراثية للجميع: ” إن وظيفة معظم ما نحمله من D.N.Aلا يزال سراً والحقيقة أن معظمه يبدو بلا فائدة ، وأن 90% من بعض أطوال الجينات لا يحمل معلومات ، ويقول أيضاً : أن علماء البيولوجية لا يعلمون إلا القليل جداً من معضلة أسرار الجينات ، وأن العلماء إذا أدخلوا جيناً (صفة) في خلية مستهدفة فسيواجه هذا الجين المدخل أحد مصيرين :
• إما أن يلتحم ب (D.N.A) الموجود فعلاً في الخلية أو يظل منعزلاً عنه كمقطع مستقل، والعلماء لا يستطيعون أن يحددوا ماذا سيحدث بل كل ما يعملوه هو أن يقوموا بإلقاء الشفرة الوراثية المأخوذة من كائن في الخلية المستهدفة ، ثم ينتظرون فقد تستطيع الخلية دمجها في المكان المناسب وقد لا تستطيع ولا علم للعلماء بالنتيجة مسبقة ولا دخل لهم في إتمامها الدقيق .
وقد تؤدي بعض تقنيات الهندسة الوراثية المصاحبة للجينات المدخلة إلى الخلية المستهدفة إلى إكساب الخلية صفات سرطانية كما يحدث أحياناً نتيجة استخدام الفيروسات أو مكوناتها لدمج جين معين في خلية حيوانية مستهدفة.
وفي كتاب مستقبلنا الوراثي للجمعية الطبية البريطانية يقول علماء الهندسة الوراثية
إن التحوير الوراثي يستخدم لعلاج الأمراض الوراثية الخطيرة، أما احتمال أن يستطيع الوالدان في يوم ما طلب أطفال بخصائص معينة فإن هذا ليس أمراً ممقوتاً فحسب وإنما هو أيضاً لا يحتمل قط التوصل إليه.
الفرق بين الوراثة والهندسة الوراثية…
الوراثــــة :
هى دراسة توارث الصفات من جيل إلى جيل ، للإجابة على سؤال : لماذا يشبه الأبناء آباءهم ؟
وقد فتح العالم جريجور مندل الباب أمام دراسة الوراثة وانتقال الصفات بعد تجاربه على نبات البسلة ) وقد وضع القانون الأول والثانى .. ثم أجريت الأبحاث على حيوانات التجارب ، الحشرات والضفادع والفئران والأرانب والماشية.
الهندسة الوراثية :
وفى عام 1953 اكتشف العالمان واطسن وكريك تركيب الحامض النووى DNA وبعد ذلك جاءت الأبحاث لحل رموز الشفرة الوراثية Genetic Code . وبمعرفة الشفرة الوراثية .. واكتشاف انزيمات بلمرة DNA وكذلك أنزيمات النسخ (التضاعف) والقطع .. ظهرت الهندسة الوراثية .. والتى تعنى : قدرة العلماء على نقل الجينات من كائن حى إلى كائن حى آخر .. بل وإمكانية نقل محتويات نواة خلية جسمية مكان محتويات نواة خلية البويضة (من نفس الكائن) ، وجعلها تنقسم لتعطى أفرادا تشبه نفس المخلوق .. بما يسمى “الاستنساخ” الذى أثار ضجة علمية واسعة .
والشريط الوراثى DNAـ كما سيأتى ـ يشبه شريط الفيديو أما الجينات ( وعددها أربعون ألفا فى نواة كل خلية بشرية ) .. تمثل المشاهد على هذا الشريط ، وهو ما يظهر من صفات بسبب هذه الجينات أو ما نسمية ( التعبير الجينى ) .. فخلية الشعر مثلا يعبر فيها عشر جينات .. وخلية الكبد يعبر فيها خمسون جينا فقط وهكذا ..
لماذا ندرس الوراثة ؟؟؟
تجنب الأمراض الوراثية…
ندرس الوراثة لتعرف توارث الصفات المختلفة .. فنتجنب الأمراض الوراثية فى العائلات .. وهذا ما نسمية ” سجل النسب الوراثى ” وفى هذا السجل نتتبع صفة وراثية معينة خلال الأجيال المختلفة .. لنعرف هل يمكن أن تظهر فى الأولاد أم لا ولنضرب مثلا على الالبينو Albino ـ والذى لا يوجد فى جلده صبغة الميلانين الموجودة فى جميع البشر ..
وهذا المرض وراثى ويرجع إلى صفة متنحية تنتج عن غياب الجين الخاص بها ـ مما يمنع تكوين إنزيم خاص بتنشيط هذه الصبغات فيتعطل ظهور اللون ..
وأيضاً مـرض السكر والضغط المرتفع والأنيميا المنجلية وغيرها .. والأبناء يولدون عندهم استعداد وراثى للإصابة بهذه الأمراض إذا كانت موجودة عند الآباء ( أو الأمهات ) أو الأجداد .
والصفات الوراثية .. وبعضها سائد تظهر فيه الصفة وبعضها متنح لا تظهر فيه الصفة وبعضها هجين .. يكون حاملاً للصفة .. ولكنها لا تظهر عليه .. وهنا ندرك أهمية دراسة سجل النسب الوراثى .وهنا أيضا تعرف أهمية التباعد فى الزواج .. والعيوب الوراثية التى يمكن أن تنشأ من زواج الأقارب !
معرفة ألوان البشر وأطوالهم…
فقد يكون الأب والأم من لون واحد .. بينما يختلف لون الأبناء وأطوالهم .. ووراثة اللون والطول من الوراثة الكمية .. والتى يبحث فيها عن لون الأجداد والأقارب وأطوالهم.
تحسـين السلالات الحيوانية…
يهدف الإنسـان إلى تحسـين سـلالات الماشـية ـ فهـو يريـد من البقر والجاموس السلالات التـى تعطى أكبر كمية من اللحم والألبان ـ ولهذا نشترى السلالات الأوربية الضخمة .. غزيرة الإنتاج ويعمل على تكاثرها .. لإنتاج الصفات الوراثية المرغوبة .
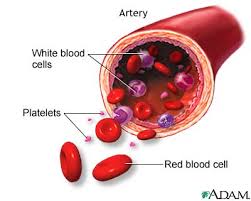
دراسة فصائل الدم في الانسان…
فصائل الدم فى الإنسان فى غاية الأهمية .. حيث تحمل كرات الدم الحمراء على سطحها مواد مولدة Antigens ويوجد فى بلازما الدم أجسام مضادة Antibodies .
فمثلا فى الفصيلة A.. مـادة مولدة على سطح الكرات الحمراء اسمهاA ومادة مضادة Bفى البلازما .. وفى الفصيلة B.. مادة مولدة على سطح الكرات الحمراء اسمها B ومادة مضادة A فى البلازما .
أما فصيلة AB فتوجد المواد B,A ولا توجد مواد مضادة ـ بينما الفصيلة O لا تحتوى على مواد مولدة .. بينما تحتوى على مواد مضادة A,B
وبدراسة وراثة الفصائل .. يمكن معرفة الأطفال .. وتحديد الأبوة المتنازع عليها .. أو نسب الأطفال لآبائهم الحقيقيين .. وذلك فى حالة اختلاط طفلين حديثى الولادة فى أحد المستشفيات مثلا: ودراسة فصائل الدم فى غاية الأهمية أيضاً عند نقل الدم فى المستشفيات فلا بد من معرفة نوع فصيلة دم المتبرع .. ونوع فصيلة دم المستقبل .. وإلا حدث التصاق لكرات الدم الحمراء ، وتجلط دم المريض المنقول إليه الدم غير المناسب لفصيلة دمه !
فلابد من إجراء الاختبارات على الدم أولاً قبل نقله إلى المريض المحتاج إلى الدم .
دراسة الشذوذ الكروموسومي…
فى الإنسان .. يوجد فى كل نواة من خلايا جسم عدد 46 كروموسوم أو صبغى وهذا العدد ثابت فى خلايا جميع البشر .. إلا الحالات الشاذة .. هذا العدد مقسم إلى 44 كرموسوم عادى وزوج من الكروموسومات الجنسية يرمز للذكر منها Y .. والأنثى X .
وعلى هذا فخلايا الذكر ( الرجل ) 44+XY
.. وخلايا الأنثى ( المرأة ) 44+XX
ولكن إذا زادت الكرموسومات الجنسية واحداً فقط رأينا حالة ( البله المغولى ) Mongols .. أو المتخلفين عقليا ويكون الذكر 45+XY والأنثى 45+XX وهذا الشكل (البله المغولى ) شائع ومعروف .
وراثة التوائم…
الأصل فى الإنسان أن ينجب طفلا واحداً .. ومدة الحمل تسعة أشهر .. لكن قد يحدث وجود أكثر من بويضة من الأنثى .. تلقح كل منها بحيوان منوى من الذكر .. فتنتج التوائم غير المتشابهة وقد تنقسم البويضة المخصبة.. فتنتج التوائم المتشابهة Identical Twins .
وقد نرى كثيرا من التوائم متشابهين تماما فى الصفات الشكلية والقدرات العقلية .. وقد نرى توائم مختلفة فى الشكل واللون … ولكنها ولدت معاً .
رسم الخرائط الوراثية…
المقصود برسم الخرائط الوراثية هو تحديد المواقع النسبية لمقاطع المادة الوراثية المختلفة فى مجموعة الكروموسومات المكونة للكائن الحي أي تعتبر الخرائط الوراثية طريقة لتقديم وتلخيص البيانات عن العلاقات الموضعية بين الجينات فى الكروموسومات .
ويتوقف رسم الخرائط الوراثية على توافر دلائل متعددة المظهر فى الكائن الحي .كانت الطريقة التقليدية لرسم الخرائط الوراثية تعتمد على الدلائل المورفولوجية ( أى المظهر الخارجي للنباتات ) مثل لون وشكل الزهرة أو الأوراق وغير ذلك إلا أن هـذه الدلائل عددهـا محدود ويمكن أن تتأثر بالعوامل والظروف البيئية النامية فيها . ومع تقدم العلم وظهور طرق التفريد الكهربائي توافر نوع جديد من الدلائل على مستوى الكيمياء الحيوية سميت بمشابهات الأنزيمات Isozymes حيث أسهمت فى تطور الخرائط الوراثية لبعض الكائنات إلا أن عددها هي الأخرى محدود وتأثرها بمراحل نمو النبات حال دون الاستفادة منها فى كثير من الكائنات الأخرى .
ثم حدثت الطفرة الحقيقية فى رسم الخرائط الوراثية مع ظهور تقنيات البيولوجيا الجزيئية الجديدة حيث وفرت دلائل على المستوى الجزئي تنتج من تتابع النيوكلوتيدات فى المادة الوراثية وهى الحمض النووي DNA وتتميز هذه الدلائل الجزئية بمميزات أهمها :
1- وفرة عددها مما يسمح بتغطية المحتوى الوراثي لجميع الكروموسومات .
2- الثبات فى توارثها حيث لا تتأثر بالعوامل البيئية .
3- إمكانية اكتشافها باستخدام الحمض النووي المعزول من أى نوع من النسيج وفى أى عمر من أعمار الكائن .
4- إمكانية حفظ الحمض النووي DNA لفترات طويلة .
ومن الدلائل الجزئية الأكثر استخداما فى رسم الخرائط الوراثية نوعان :
النوع الأول ويطلق عليه RFLP
وهذا النوع يعتمد على إظهار التباين أو الاختلاف فى الدلائل عن طريق هضم الحمض النووي DNA بعد استخلاصه من الكائن بواسطة إنزيمات القطع المحددة (إنزيمات خاصة بقطع الحمض النووي فى أماكن محدده ) وتظهر هذه الاختلافات بعد إجراء الاختبار على هيئة حزم Bands مختلفة فى الوزن الجزيئي والطول .
النوع الثانى ويطلق عليه RAPD
وهذه الدلائل تعتمد على استخدام كمية ضئيلة جداً من الحمض النووي DNA لإنتاج نسخ من قطع معينة فى الحمض النووي باستخدام جهاز PCR مع وجود بادئات صغيرة من الحمض النووي ( 9- 10 قواعد نيتروجينية ) ويكشف التباين مع ظهور حزم ( Bands ) معينة فى بعض الأفراد واختفائها فى البعض الأخر .والخرائط الوراثية المشبعة بالدلائل الوراثية وقدأصبحت هذه الخرائط ذات أهمية كبيرة بالنسبة لعالم الوراثة ومربى النبات أو الحيوان لما تلعبه من دور بارز فى دراسة المحتوى الوراثي بدرجة عالية من الدقة لم تكن متوفرة بالطرق الأخرى كذلك إمكانية تحديد مواقع الجينات التي تتحكم فى الصفات الاقتصادية الهامة .
وأيضاً توفير الوقت اللازم لتنفيذ برامج التربية والتحسين الوراثي عن طريق استخدام أسلوب الانتخاب عن طريق الدلائل فمثلا إذا استطعنا أن نحدد دليل ( مقطع أو مقاطع معينة من الحمض النووي DNA ) يرتبط بظهور صفة اقتصادية هامة مثل المقاومة للمرض أو زيادة المحصول أو غير ذلك فيمكن عن طريق إجراء اختبارات على مستوى الحمض النووي DNA باستخدام تقنيات البيولوجيا الجزئية انتخاب نباتات حاملة لهذه الدلائل والتي ترشد المربى إلى وجود الصفة المرغوبة فى أقل وقت ممكن بالمقارنة بالطرق التقليدية التي تحتاج إلى وقت طويل.
التطبيقات العملية على تقنية إعادة إتحاد DNA ( الهندسة الوراثية )…
الإنتـاج المكثـف لنواتـج الجينـات…
وهو أول تطبيق علمى للهندسة الوراثية وقد تم فيه عزل الجينات وعمل نسخ خضرى Cloning للجينات التى تنتج هرمون النمو Growth Hormon ( GH ) وهرمون الأنسولين Insulin فى الإنسان وهذه الجينات الآن تدمج روتينيا فى البكتريا وتنمى وبالتالى تنتج كميات كبيرة من هذه الهرمونات ( لاحظ أنها هرمونات بروتينية – راجع تركيب البروتينات ) للاستخدام التجارى فى علاج بعض الأمراض سواء الوراثية أو غيرها ، وبمعنى أخر أن هذه البكتريا تحولت إلى مصانع للهرمونات .
ولإيضاح التقدم الذى أحرزته الهندسة الوراثية فى هذا المجال ، نجد أنه قبل استخدامها كان دواء هرمون الأنسولين لمرض البول السكرى يستخلص من بنكرياس الحيوانات مثل الخنزير والأبقار والجاموس والأغنام وكان هذا مكلفا جدا كما كان يستغرق وقتا طويلا ، بالإضافة إلى ذلك فهو ينتج هرمونات غير مطابقة كيميائيا لتلك الموجودة فى الإنسان . ونتيجة لذلك كان الجسم يعامل هذه الهرمونات كمواد غريبة ويهاجمها عن طريق الجهاز المناعى ، وبالتالى فهذا يتطلب تغيير استخدام الهرمون المستخلص من حيوان معين إلى هرمونات مستخلصة من انواع أخرى من وقت لآخر . وبالمثل تستخدم الشركات الهندسة الوراثية لتصنيع هرمون النمو GH لمعالجة بعض الأطفال فى حالة خلل فى إفرازات الهرمون من النخامية .
وقبل التقدم فى الهندسة الوراثية كان من الصعب الحصول على هرمون النمو وكان عالى التكلفة بدرجة كبيرة .
نقـل الجينـات فـى النبـاتـات والحيـوانـات …
قام مربوا الحيوانات والنباتات منذ مئات السنين أو قد يكون آلاف السنين بانتخاب حيوانات ونباتات بها صفات وراثية لها قيمة اقتصادية . وبالتالى فيتضح لك من الوهلة الأولى أنهم كانوا ينتخبوا حيوان أو نبات به جينات معينة مما يؤكد استخدامهم لنوع من أنواع الهندسة الوراثية منذ زمن بعيد .
لكن عملية تحسين الصفات بالانتخاب بالرغم من أنها انتخاب لقيمة وراثية عالية إلا أنها عملية بطيئة جدا . أما الهندسة الوراثية فهى عملية سريعة ولا تحتاج لعدة أجيال مثل الانتخاب .
هذا وفى السنوات الماضية تمكن العلماء من غرس جين يستخدم كشفرة Code لتكوين هرمون النمو Growth Hormone (GH ) المأخوذ من الإنسان لزراعته فى أجنة الماشية وذلك بغية إنتاج ماشية أسرع نموا عن تلك الطرق التقليدية المستخدمة ( الانتخاب ) . وبالطبع فالماشية الأسرع نموا تستطيع إنتاج لحوم أكثر لكل وحدة وزن من الغذاء ، وبالإضافة إلى ذلك فإن هرمون النمو المزروع فى الماشية يزيد إنتاج اللبن فى حيوانات اللبن .
كما يعمل علماء تربية النبات وتربية المحاصيل مع علماء الوراثة حاليا على تحسين النباتات فقد تمكن هؤلاء العلماء من الحصول على جينات تسمح للشوفان بتحمل ملوحة التربة، كما أن نقل نفس هذه الجينات إلى أنواع أخرى من المحاصيل التى لها قيمة تجارية عالية يسمح للهيئات الزراعية باستخدام مساحات كبيرة من الأراضى غير المستعملة الآن بسبب تراكم الأملاح بها .
العلاج بالجينات …
هناك عدة حالات ليست بالقليلة من الأطفال الذين يولدون فى معظم بقاع العالم وهم يعانون من خلل وراثى Genetic disorder خطير مثل مرض أنيميا كريات الدم المنجليةSickle cell anemia وهو مرض وراثى أو من مرض وراثى آخر وهو مرض النزف الدموى : هيموفيليا Hemophilia ( لاحظ أن هذه الأمراض تصيب حوالى 1% من الأطفال ) . ومن الممكن أن يؤدى التقدم فى بحوث الهندسة الوراثية إلى استنباط طرق لاستبدال الجينات المختلة Defective genes بجينات سليمة ، وبذا تعالج كثير من الأمراض الخطرة ( قد تكون مميتة ) والمكلفة فى نفس الوقت ، لكن يجب ملاحظة أن هناك عقبة كبيرة سوف تقابل الباحثين فى هذا الشأن ألا وهى كيفية إدخال هذه الجينات واستبدالها فى خلايا جسم الإنسان .
هذا وقد حقق العلماء نجاحا فى معالجة حالة مرضية موجودة فى الفئران وهو مرض وراثى نادر يسمى Krabbe’s disease وهذا المرض ناتج عن نقص إنزيم واحد معين ، ويسبب نقص هذا الإنزيم تراكم الدهون فى الجهاز العصبى كما يسبب تحلل الخلايا العصبية أيضا . وهذا المرض يصيب الإنسان أيضا حيث يسبب له نوبات مرضية ومشاكل فى البصر فى بداية الحياة فى الإنسان ، ومعظم المرضى بهذا المرض فى الإنسان يموتون فى العامين الأولين من العمر . وقد تم اكتشاف سلالة من الفئران تعانى من نفس الحالة ونجح العلماء فى حقنها بخلايا نخاع عظام من فئران سليمة وراثيا حيث استقرت هذه الخلايا فى الكبد والرئتين وأعادت النشاط الإنزيمى طبيعيا ، كما نجحت أيضا فى الوصول إلى المخ ( لاحظ أن خلايا مخ المرضى بمرض Krabbe’s disease تعانى بشدة من نقص هذا الإنزيم ولذلك فالعلاج المطلوب فى هذه الحالة يجب أن يشمل استبدال المادة الوراثية فى هذه الخلايا ) .
ويجب ملاحظة أن هناك طرقاً كثيرة أخرى لكن الطريقة الأكثر احتمالا للنجاح هى استخدام الكريات الدقيقة Microspheres وهى كريات دهنية صغيرة . ويمكن إحاطة هذه الكريات بأجسام مضادة والتى تسمح لهم بتوصيل محتوياتها من جينات أو جينات بديلة لخلايا الجسم.
بالإضافة إلى ذلك فقد طور العلماء تقنية حديثة للغرس Implantation وهذه التقنية قد تساعد علماء الطب فى إدخال خلايا معامله وراثيا فى جسم الإنسان . فقد قام العلماء بإحداث تغيير وراثى فى خلايا كبد ( هذا التغيير تم فى مادة رغوية ـ إسفنجية Foam like ) وقاموا بحقن هذه الخلايا فى الفئران حيث غرست المادة الرغوية فى الفئران بعد تشربها بهرمون ينشط نمو الأوعية الدموية من الأوعية الأكبر القريبة. وبعد أسبوع من الغرس أصبح النسيج الشبه صناعى محاط بشبكة من الأوعية الدموية ،وبالتالى فيمكن تطبيق هذه التقنية باستعمالها فى إدخال خلايا معاملة وراثيا أو خلايا جنينية فى المرضى المصابين بأمراض وراثية ، كما يمكن استخدام هذه التقنية أيضا فى الأفراد المصابين بمرض السكر حيث يمكن استبدال خلايا Cells-ß فى البنكرياس والتى ضعف نشاطها بالنسبة لإنتاج هرمون الأنسولين بخلايا نشطة فى إنتاج هذا الهرمون ، وأيضا بالنسبة للمرضى المصابين بمرض Parkinson فيمكن إعطاؤهم خلايا منتجة للدوبامين Dopamine .
استخدام المبيدات الحيوية ( صديقـة البيئـة )…
فى منتصـف هذا القـرن سلط الضـوء على نـوع من البكتريا يطلق عليها “Bacillus thuringiensis” وهى كائن حى وحيد الخلية يوجد طبيعياً فى التربة وذلك لقدرته على إبادة أنواع معينة من الحشرات وهى ظاهرة بيولوجية طبيعية يتصف بها هذا الكائن البكتيرى.
ويكون تأثير هذه البكتريا الفعال فى السيطرة على هذه الأنواع من الحشرات أثناء طور اليرقة فقط ( الدودة ) وهذا الطور اليرقى يعتبر أنشط أطوار الحشرة حيث تكون شرهه للتغذية على الأوراق ومثال ذلك دودة ورق القطن التى تتغذى على أوراق القطن كذا دودة اللوز القرنفلية التى تتغذى على لوزة القطن.
وقد استفاد الإنسان خلال تطبيقات البيوتكنولوجى الحديثة من هذه البكتريا حيث أمكن إنتاج البكتريا بكميات هائلة من خلال مخمرات كبيرة الحجم والسعة فى أوساط غذائية صناعية ثم نتدرج فى خطوات الإنتاج حتى نصل إلى شكلها النهائى على هيئة مسحوق يرش به النباتات ، هذا المبيد البكتيرى يرش على النباتات التى تصاب باليرقات التى تتغذى على الأوراق وعندما تأكل اليرقة هذه البكتريا أثناء التغذية على الأوراق فإن البروتين السام الناتج فى البكتريا يصيب الجهاز الهضمى لليرقة ويسبب لها شللاً فلا تستطيع أن تأكل وفى النهاية يؤدى إلى موتها.
ويلاحظ فى هذا النوع من المبيدات الحيوية ما يلى :
1- شدة تخصص المبيد لأنواع معينة من الحشرات .
2- لا يؤثر على الأنسان أو الحيوان أو الحشرات النافعة الأخرى .
3- آمن تماماً للبيئة حيث لا يترك أى آثار سامة على النباتات أو فى التربة بعكس ما يحدث فى حالة المبيدات الكيميائية لمقاومة الآفات .
.4- يؤدى إلى حماية النباتات المعاملة وحصول المزارع على أكبر عائد أقتصادى
وقد أمكن لمعهد بحوث الهندسة الوراثية الزراعية من عزل وتعريف هذا النوع من البكتريا من التربة ثم إنتاجه على هيئة مسحوق يمكن استخدامه فى مقاومة الآفات الحشرية ويطلق عليه AGERIN أجرين .
إنتاج نباتات مقاومة للملوحة والجفاف والحرارة…
تنحصر الزراعة فى مصر فى مناطق الوادي والذي يمثل 5 % من مساحة مصر التى تبلغ حوالي مليون كيلو متر مربع وذلك على الرغم من وجود مساحات شاسعة من الأراضي إلا أنها أراضى صحراوية لذلك اتجهت السياسات الزراعية إلى نظرية التوسع الأفقي وذلك للخروج من الوادي الضيق إلى الأراضي الصحراوية وهو ما يمثله مشروع الوادي الجديد في توشكي بجنوب مصر .
ولكن الزراعة فى الأراضي الصحراوية تواجه مشكلات عديدة أهمها الظروف البيئية المعاكسة منها الجفاف والملوحة والبرودة والحرارة ومن المعروف أن مصر لا تعتمد في الري على الأمطار لندرتها كما أن مياه الآبار قليلة وصعبة الاستخراج من باطن الأرض و أن المحتوى الأرضي في الصحراء به نسبة أملاح عالية كذلك فإن المناخ الصحراوي يتميز بشدة التطرف ( شديد الحرارة نهارا شديد البرودة ليلا ) وهنا يظهر دور الهندسة الوراثية فى حل هذه المشاكل وذلك بإنتاج نباتات مهندسة وراثياًُُ تتحمل جميع الظروف البيئية غير الملائمة فينجح زراعتها فى الصحراء .
ولكي يتم إنتاج هذه النباتات يجب ان نعرف العوامل الوراثية ( الجينات ) المسئولة عن مقاومة هذه الظروف و من ثم يتم عزلها ثم نقلها إلى النباتات ذات الأهمية الاقتصادية المراد استزراعها فى مصر .
– و يتم ذلك بدراسة النقاط التالية :-
1- معرفة العوامل الوراثية ( الجينات ) التي تلعب دورا هامـا فى مقاومة العوامل البيئية المعاكسة .
2- معرفة ودراسة المصادر الطبيعية لهذه الجينات ثم عزلها .
3- عزل الجينات بالطرق المعملية .
4- توصيف الجينات .
5- نقل الجينات إلى النبـاتــات المـراد زراعتهـــا .
6- عمل الاختبارات اللازمـة على هذه النباتـات قبل تداولها .
وعلى مدار بضع سنوات مضت ظل علماء الهندسة الوراثية فى سباق مع الزمن لمعرفة وتحديد الجينات التي تقاوم الضغوط البيئية و قد أمكن عزل العديد منها حتى الآن وبالرغم من أن معظم وظائف هذه الجينات لا زالت غير معروفة إلا أنه من المؤكد أن هذه الجينات تعمل فى سيمفونية منسجمة لمقاومة هذه الظروف البيئية غير الملائمة حيث أن تلك الظروف تشترك فى نفس التأثير على النبات ، كما نرى أن الجفاف يؤدى إلى قلة المحتوى المائي وأن الحرارة تؤدى إلى تبخر الماء وبالتالي قلة المحتوى المائي فى الخلايا ، كذلك فإن الملوحة تؤدى إلى زيادة الضغط الإسموزى فى الخلايا و في النهاية قلة المحتوى المائي أيضا لذا فان معظم هذه الجينات مشتركة فى مقاومة العوامل البيئية كلها.
ويتم جمع النباتات ثم عزل الجينات منها بطرق عديدة منها PCR وهى طريقة كيميائية معقدة يتم فيها مضاعفة الجين المطلوب عن طريق بادئات صغيرة من الأحماض النووية لتحديد بداية و نهاية الجين المطلوب وبعد انتهاء التفاعل يكون لدينا الجين في صورة سهلة التداول لإدخاله إلى البكتيريا التي تقوم بنقله إلى داخل النبات . بعد ذلك يتم التأكد من صلاحية هذه النباتات للاستعمال البشرى ، وإن هذه النباتات ليس لها أية أضرار على البيئة المحيطة ، كما إن صفات المقاومة ثابتة فيها وفى النهاية يكون لدينا نبات يستطيع تحمل الظروف البيئية المعاكسة و يمكن زراعته فى الصحراء
تطبيقات أخرى للهندسة الوراثية…
أ ـ إنتاج الأمصال والطعوم ( التطعيمات الإجبارية ) والتى تعطى للأطفال منذ الولادة وحتى دخول المدرسة ـ مثل التطعيمات ضد الدفتريا والسعال الديكى والتتيانوس وكذلك فيروسات شلل الأطفال وغيرها .
ب ـ إنتـاج المـواد التشخيصية … للكشـف عـن الأمـراض مبكرا فى الدم مثـل الدرن وقرحـة المعدة. وكذلك فيروسات الكبد مثل – Antigen HBV والأجسام المضادة لها وكذلك الطفيليات مثل : الديدان الكبدية وديدان البلهارسيا .
ج ـ تشخيص الأمراض الوراثية بدراسة تحاليل كروموسومات الخلية وذلك بأخـذ عينـة من الـدم بالنسـبة للأم أو الأب لمعرفـة ما إذا كان يحمـل كروموسوماً مريضا أم لا مثل كرموسوم فيلادلفيا .
وحتى أمراض العيوب الوراثية فى التمثيل الغذائى لحديثى الولادة ( والكبار أيضا ) مثل أنيميا الفول ونقص الانزيم الهاضم لللبن وغيرها .
وقد تم إجراء تحاليل للأمراض الوراثية على مستوى الجين .. وهو ما يتم الآن فى الدول المتقدمة ( وفى مصر أيضا ) Gene level diagnosis مثل Thalassemia By PCR وهى أنيميا البحر المتوسط الوراثية ..وكذلك مرض ضعف العضلات الوراثى المسمى Duchenne muscle dystrophy ومرض نزف الدم Hemophilia A& B by PCR وغيرها .
د- مشروع الجينوم البشرى بهدف التعريف الكامل بجينات الإنسان .. ورسم خريطة كاملة لها ، ومعرفة الوظيفة الحقيقية لكل جين .. وهو مشروع بحثى ضخم تُعد له الدول الكبرى ميزانيات ضخمة .
هــ فى مجال إنتاج قطع غيار للأنسجة البشرية نجحت الأبحاث على مستوى الخلية .. مثل إنتاج الأنسولين البشرى من خلايا بشرية .. وإكثارها عن طريق الخلايا البكتيرية أو المزارع التخليقية .
كما نجحت الأبحاث العلمية فى إنتاج نسيج كامل مثل الجلد .. حيث ثم إكثار خلايا الجلد لتعطى ملايين الخلايا المتلاصقة .. مثل الجلد الأصلى .. وبذلك يمكن ترقيع الجلد وخاصة فى الحروق الكبيرة ـ والحوادث التى يصحبها تهتك فى كمية كبيرة من الجلد . ونجحت بعض الأبحاث فى أنسنة بعض أنسجة الحيوان وذلك لنقلها إلى جسد الإنسان مثل الكبد أو الكلية أو القلب .
تاريخ الهندسة الوراثية …
حتى تاريخ 1970 ميلادية كان إجراء الأبحاث على الحمض النووي ( الدي إن أي)من أصعب الأمور التي كانت تواجه علماء الوراثة و الكيمياء.و كانت معظم الأبحاث تجرى بشكل غير مباشر على الحمض النووي الريبوزي (الأر إن أي)أو البروتين.و لكن الحال تحول بشكل كامل فأصبح علم الوراثة المتعلق بفحص الدي إن أي(و المعروف بعلم الوراثة الجزيئية)من أسهل العلوم و أكثرها تطورا.لقد أصبح من السهل صنع نسخ عديدة من أي جين (مورث) أو مقطع محدد من الدي إن أي.كما أمكن معرفة تسلسل الأحماض النووية بسرعة تتعدى المئات في اليوم الواحد.كما استطاع العلماء استكشاف الجينات الموجودة في على الكروموسومات كما استطاعوا تغيير و تعديلها بشكل الذي يريدون و ليس هذا فحسب بل استطاعوا أن يعيدوا هذه الجينات المعدلة إلى الخلية و غرزها في الكروموسوم الذي يريدون.كما أمكن إنتاج كميات كبيرة من البروتينات كالهرمونات و اللقاحات المختلفة و التي كانت تنتج في السابق من الجثث الميتة أو تستخلص من الحيوانات و التي كانت تحوفها المخاطر من انتقال العدوى إلى الإنسان.كما أن هذه الثورة العلمية فتحة المجال أمام الكثيرين من محبي هذا العلم في اختراع و اكتشاف طرق جديدة و حديثة في التعامل و حفظ و تغيير هذه المادة الحيوية في الإنسان و الحيوان و النبات.لقد غير هذه العلم المنطلق كالصاروخ الكثير من المفاهيم الطبية و التي دفعة كثير من كليات الطب إلى تعديل مقرراتها لتزويد طلابها بالمزيد من هذا العلم.
لقد أُطلق على عملية نسخ و تعديل و زرع الجينات اسم الهندسة الوراثية و هو اسم عام لا يحدد فكرة معينة أو تقنيه محدده، ولكنه يعني بكل ما يقام به في تغيير أو تعديل المادة الوراثية.و يتفرع من هذا العلم الكثير من التقنيات و هي متناثرة و موزعة على الكثير من فروع الطب و العلوم.و ليس للحصر إليك أهم 6 تقنيات تختص بالهندسة الوراثية:
1-قص و قطع الحمض النووي(Cleavage of DNA ) بمقصاة خاصة تسمى (Restriction Nucleases )و اكتشاف هذه المقصاة ساعد كثيرا في مهمة التحكم في الدي إن أي.
2- فصل قطع الدي إن أي على لوح من الجل بالكهرباء (Gel Electrophoresis ).
3-معرفة التسلسل النووي(DNA sequencing ) لكل قطع الدي إن أي التي يتم عزلها بشكل سريع و دقيق.و التي تسمح للعلماء معرفة التركيب الإنشائي للجينات و معرفة و استنتاج نوع البروتين الذي ينتج منه.
4- تقنية تهجين الحمض النووي(Nucleic acid hybridization )، و التي مكنتنا في معرفة أحجام القطع من الحمض النووي و الكشف عن القطع المحددة من الحمض النووي في خليط معقد من القطع المتشابهة.
5-استنساخ الدي إن أي(DNA cloning )، و التي تسمح بإنشاء نسخ عديدة و متطابقة من القطع الدي إن أي.
6-تقنية هندسة أو تعديل الدي إن أي (DNA engineering )، و التي تسمح بإنتاج نسخة معدلة من جين ما ثم أعادته مرة أخرى إلى الخلية.
تقنيات الهندسة الوراثية…
القطع المحددة…
عندما يضاف الإنزيم القاطع إلى محلول به شريط من الدي إن أي فانه يقطّعه إلى عدة قطع و ليس إلى قطعتين فقط.و كل قطعة مقطوعة بالإنزيم تسمى قطعة محددة.و يختلف طول هذه القطع على حسب المسافة التي بين كل مقطع و أخر.و لكن يجب أن تكون كل قطعة محددة لها نفس الحجم في كل نوع من الكائنات الحية.و ذلك يعني أن جميع الناس(الإنسان)لديه قطعة محددة معينه يقطعها الإنزيم القاطع هيبا واحد في الكروموسوم رقم 2.و يمكن التأكد من ذلك بتحليل قياس لهذه القطعة بتقنيه حركة الدي إن أي الكهربائية على الجيل(انظر موضوع حركة الدي إن أي الكهربائية في الجل( Gel Electrophoresis).و إذا لم حدث أن وجد إنسان ليس لديه نفس الحجم المفترض للقطعة ففي هذه الحالة نستنتج أن هذا الشخص لدية طفرة(تغير في تسلسل الدي إن أي)في احد الأماكن التي كان من المفترض أن يقصها الإنزيم فلم يتم القطع فيها.و بذلك فان حجم القطعة قد اختلف تعرف هذه الظاهرة عند علماء الوراثة بتفاوت القطع المحددة المصحوب بطفرة.
قص و قطع الحمض النووي…
كما هو معروف فان البروتينات موجودة داخل الخلية على شكل قطع منفصلة عن بعضها البعض و هذا بالطبع سهل عملية فصلها عن بعضها البعض بطرق فنية مناسبة.ولكن الجينات موجودة على الكروموسومات على شكل حبات متصلة ببعضها البعض و ليست على شكل قطع منفصلة.وهذا التسلسل و الترابط في الجينات جعل عملية فصله و عزل و استخلاص جين محدد من بقيه الجينات مهمة صعبة ان لم تكن مستحيلة قبل عام 1970.
ولكن اكتشاف الإنزيمات القاطعة(Restriction Nucleases ) ساعد في عملية استخلاص الجينات و قطع الدي ان أي و نسخها .
الإنزيمات القاطعة…
لا شك أن كل كائن حي لديه طرق دفاع مختلفة تحميه من غارات الأعداء و هجوم المعتدين! و البكتيريا هي إحدى هذه الكائنات و لها أعداء كثر و من أهم أعدائها الفيروسات المختلفة.و لقد قامة بعض من البكتيريا بإنتاج خمائر(إنزيمات) مهمتها تدمير الفيروسات.و من هذه الإنزيمات الإنزيمات القاطعة أو (Restriction Nucleases).و تقوم هذه المقصاة أو القواطع بقص الحمض النووي(الدي إن أي)للفيروس و بذلك يشل عمله و يبطل مفعولة. و بما أن الدي إن أي مادة موجودة بشكل طبيعي في البكتيريا كما هو الحال في الفيروسات و الكثير من الكائنات الحية فان هذه المقصاة قد تشكل خطرا على البكتيريا نفسها في قصها لدي إن أي الخاص بها.ولكن هذا لا يحدث و السر في ذلك هو قيام البكتيريا بتحوير أجزاء من الدي إن أي الخاص بها عن طريق إضافة مجموعة الميثيل( Methyl) إلى بعض الأحماض النووي من نوع الادنين او السيتوسن(Methylation at an A or a C residue ) فلا يستطيع المقص أو القاطع من قص الحمض النووي الخاص بالبكتيريا.و عند اكتشاف هذه القواطع في السبعينيات الميلادية بدأ العلماء في استخدامها كمقصاة لقص الدي إن أي .و ساعدتهم هذه المقصاة في عملية التحكم في الدي أن أي.و يوجد حاليا أكثر من مائه نوع من هذه المقصاة.و تقسم هذه المقصاة إلى نوعين رئيسيين، النوع الأول يقص شريط الدي إن أي المزدوج بشكل رأسي مستقيم(Blunt ends) و النوع الثاني يقص بشكل متعرج(Staggered cuts, ) و بتالي يجعل طرفي الدي إن أي المقطوع مادة قابلة “للزق”قطعة غريبة من الدي أن أي فيها.و عن لزق قطعة من الدي إن أي في داخل الفراغ الناتج من القطع ينتج لنا قطعة مركبة من قطعتين مختلفتين من الدي إن أي و هذه القطعة تسمى دي إن أي مهجّن أو (Recombinant DNA).
كيف يتعرف الإنزيم القاطع على المكان المفترض أن يحدث القطع فيه؟
كل إنزيم قاطع يعتبر عن مقص خاص لقطع الدي إن أي في نقطة محددة.و يتعرف الإنزيم القاطع على مكان القطع حسب تسلسل الدي إن أي للقطعة.فكل إنزيم قاطع يقطع في تسلسل محدد.فمثلا الإنزيم القاطع المعروف بالهيبا و احد(Hpa I )يقطع عندما يجد 6 من الأحماض النووية في هذا التسلسل ( GTTAAC) بينما الإنزيم القاطع إيكو أر واحد (Eco RI ) يقطع عندما يجد 6 من الأحماض النووية في هذا التسلسل( GAATTC).و للمعلومية فان هيبا واحد سمي بهذا الاسم لأنه يوجد في بكتيريا الهيموفلس بارا انفلونزا (Hemophilus parainfluenzae ) و هذا الإنزيم يعتبر من الإنزيمات التي تقطع بشكل رأسي مستقيم.بنما انزيم الايكو ار واحد فهو مأخوذ من بكتيريا الايكو كولي (Escherichia coli )، ويعتبر من الإنزيمات التي تقطع بشكل متعرج.
الناقلات…
الناقل و التي تسمى باللغة الإنجليزية “فيكتور” هي في الغالب فيروسات أو قطع من الحمض النووي موجودة في البكتيريا.كما أن هناك أنواع صناعية تم صنعها في المختبرات الطبية و هي في العادة مواد شبه صناعية لأنها في الأصل مصنعة من مواد موجودة في الطبيعة.
البلازميد…
هي من اشهر الناقلات ،و هو عبارة عن قطعة صغيرة من الحمض النووي قابلة للتكاثر بمعزل عن بقية الحمض النووي الموجود في الكروموسومات .و هي شبيهة بالفيروس الصغير و لكنها لا تحتوي على طبقة خارجية من البروتين.
. و البلازميد عبارة عن قطعة من الحمض النووي موجود في البكتيريا خاصة في الاي كولي(E.Coli) و بعض أنوع الخميرة ( Yeast) .و لدية القدرة على التكاثر الذاتي و بمعزل من بقية الكروموسومات
الموجودة في الخلية.كما أن هناك بلازميدات تستطيع التكاثر داخل البكتيريا و الخميرة في آن واحد. و يوجد نوعان من البلازميد على حسب نوع الحمض النووي فيها فهناك البلازميد المصنوع من الدي إن أي (DNA ) و نوع أخر مصنوع من الأر إن أي (RNA ). و هناك أنواع عديدة من البلازميد فمنها الصغير و منها الكبير كما أن منها ما لا يحتوي على أي جين بينما هناك أنواع كبيرة تحتوي على عدة جينات.و بالإضافة إلى وحدة التكاثر الذاتي الموجد على البلازميد هناك الكثير من الجينات التي قد تكون على البلازميد و هي مفيدة للعلماء في عملية نسخ الجينات و القطع النووية فمثلا فد يوجد على البلازميد جين خاص يكافح المضادات الحيوية كالمبيسيلين و التترسيكلين .و هذه الجينات الحامية من المضادات الحيوية تساعد في التعرف و عزل البكتيريا التي تحتوي على البلازميد الذي عليه الجين الذي كنا ننوي استنساخه (للمزيد راجع عملية نسخ الجينات و القطع النووية)و يعتقد نظريا أن الفيروسات المنتشرة في الأصل كانت بلازميدات حيث أنها اكتسبت غلاف بروتيني خارجي و أصبحت فيروساً.
الناقلات الفيروسية…
إن اشهر هذه الأنواع هي الفيروسات البكتيرية المعروفة بالفيج ( Phage). و هي عبارة عن قطعة من الدي ان أي مغطاة بغلاف بروتيني. ومن اشهر أنواع الفيج ما يسمى بفيج لمدا (lambda phage) و هو فيروس موجود في الاي كولي E. coli. وهذا النوع من الناقلات تستطيع أن تحمل قطعة من الدي إن أي حتى غاية كيلوبيز.و لقد حوّرت هذه الفيروسات لكي تستطيع حمل كمية اكبر من الدي إن أي.فعلا سبيل المثال الكوزميد ( Cosmids ) عبارة عن تهجين جزء(قطعة من الدي ان تسمى اللاصقة cohesive sequence و تعرف مختصرة بالكوز Cos sequence) من فيج ليمبدا(Phage ) مع بلازميد (Plasmid ) و الذي يستطيع نقل حتى 40 كيلوبيز (40kb ) و الباك الفيروسي المسمى بكروموسوم بي 1 الصناعي (PAC P1-derived Artificial Chromosomes / ) عبارة عن تحوير للفيج بي 1 (P1 Bacteriophage ) و إضافته إلى البلازميد..
الناقلات الكروموسومية الصناعية…
نظرا للحاجة إلى نقل إحجام كبيرة من الدي إن أي فقد قام بعض العلماء بتحوير بعض الناقلات الطبيعية لكي تقوم بهذه المهمة.و يوجد حاليا ناقلات على شكل كروموسوم و فيها القطع الأساسية لكي تعمل على شكل كروموسوم.و من هذه الأنواع ما يعرف بــ الياك او كروموسوم الخميرة الصناعي(Yeast Artificial Chromosomes / YAC ) و الذي يستطيع نقل أكثر من 500 كيلوبيز (500 kb ).و الياك عبارة عن قطعة من الدي ان أي مترابطة و تحتوي على طرفين للكروموسوم(2 Telomeres) و مركز للكروموسوم(Centromere) و مركز للتكاثر(Autonomous replicating sequence ARS).بينما الباك البكتيري(Bacterial Artificial Chromosomes / BAC )و الذي يستطيع حمل حتى 150 كيلوبيز (150 kb ) هو تحوير للبلازميد المعروف ببلازميد تناسل بكتيريا الايكولي(E.coli fertility plasmid-factor)).
معرفة التسلسل النووي…
لا شك أن العلماء يحتاجون إلى معرفة التركيبة التسلسلية لكل جين و هذا يمكنهم من معرفة المزيد عن البروتين الذي يصنعه ذلك الجين وعن التركيبة التنظيمية لعمل الجين و قد يصلون على ضوءه إلى معرفة الأمور التي تتحكم في عمله.كما انه بمعرفة التسلسل النووي للجين يمكن مقارنته بالجينات التي سبق اكتشافها و هذا قد يعطي معلومات غزيرة عن وضيفة هذا الجين و يختصر الكثير من الابحاث
و يتجنب اعادة اجرائها.وهناك طريقتان أساسيتان لمعرفة التسلسل النووي لأي قطعة من الدي إن أي.الأولى تسمى بالطريقة الإنزيمية (Enzymatic method ) و الأخرى بالطريقة الكيميائية(Chemical ).و لقد طغت الطريقة الأولى حتى أصبحت هي الطريقة الأكثر استعمالا.
الطريقة الإنزيمية…
يطلق على هذه الطريقة أيضا طريقة سنجر (Sanger procedure )نسبة إلى د.فريدريك سنجر و الذي أسس هذه الطريقة.كما أنها أيضا تعرف التسلسل عن طريق دي ديوكسي (dideoxy sequencing).و تترتكز هذه الطريقة على مفهوم أن شريط الدي إن أي في الأساس مبنى من جزيئات من الديوكس نيوكلويتيد (deoxynucleotides (dNTPs )و يوجد على النقطة الثالثة من حلقة السكر الريبوزي مجموعة مؤكسدة أي مجموعة هيدروكسيه( OH)و هذه النقطة هي التي ترتبط في النقطة الخامسة من الجزيء الذي يليها و هكذا يتم الترابط لتكوّن شريط طويل من الدي إن أي.و لقد قام د.ستنجر بالاستفادة من هذه الخاصية فبدّل الجزيء من (OH)إلى (H ) عن طريق إضافة دي ديوكسيو بيوكلوتيد(ddNTPs) بدل من ديوكسي نيوكلوتيد(dNTPs ) و ذلك عن طريق نسخ الشريط مرة أخرى و هذا يؤدي الى توقف ترابط الجزيئات و يكون في طرف كل جزيء نوع واحد من الأحماض النووية.
• يختلف الديوكسي نيوكلويتيد عن دي ديوكسي بيوكلوتيد بعدم و جود مجموعة (هيدروكسي)في النقطة الثالثة من حلقة السكر الخماسية الشكل ( كما هو موضح بالشكل ).
فصل قطع الدي إن أي على لوح من الجل بالكهرباء…
استعمل العلماء تقنية فصل البروتينات عن بعضها البعض بطريق انتقالها(رحلان) و انفصالها عن بعضها البعض، و ذلك عن طريق تعريضها إلى تيار كهربائي و هي على لوح من المادة الهلامية المعروفة بالجل.ولقد استعمل العلماء نفس الفكرة في فصل قطع الدي إن أي عن بعضها البعض.ومن المعروف أن الحمض النووي عبارة عن شحنة سالبة و لذلك فعند و ضع بعض من الدي إن أي في طرف من أطراف لوح الجيل ثم وتعريضها لتيار كهربائي بحيث يكون القطب السالب عند الطرف الذي وضعنا فيه الدي إن أي و القطب الموجب عن الطرف الأخير من ألواح فان الدي إن إي ينتقل تلقائيا بتجاه الطرف الذي فيه.
القطب الموجب و تتوقف حركة قطع الدي إن أي على حسب إحجامها على طول اللوح.فالقطع الصغيرة تتحرك بشكل اكبر من القطع الكبيرة. و بذلك يمكن فصل هذه القطع عن بعضها البعض.و يمكن تحديد ا لحجم الفعلي لكل قطعة عن طريق إضافة قطع معروفة الحجم من الدي إن أي و التي تكون مقياس يرجع إليه لاستنتاج أحجام القطع.
وهناك نوعان أساسيان من ألواح الجيل.الأول يسمى بجيل الاقروز (Agarose gel ) و الثاني بجيل البولي اكريليميد(Polyacrylamide gel ).و نظرا لصغر الفراغات التي بين البولي اكريليميد فانه يستخدم لفص القطع الصغيرة الحجم من الدي ان أي و في العادة التي تكون اصغر من 500جزيء من الحمض النووي و التي تتفاوت بين بعضها البعض بجزيء أو جزيئين (انظر الرسم A)..بينما يستخدم الاقروز للأحجام الأكبر من الدي إن أي. و التي يتراوح حجمها بين 300 إلى 10000 جزيء من الدي إن أي (انظر الرسم)..ومادة الاقروز هي مادة سكرية مستخرجة من الطحالب و عند تحضيرها فإنها تشبه في قوامها الجيلاتين الذي نأكله و لكنها أقوى في قوامها بعض الشيء و لكنها قابلة للتهتك أو الانقطاع عند نقلها بغير حرص.